
К элементам основной подгруппы группы VI периодической таблицы Менделеева относятся:
- Кислород или
- Сера С
- Селен Se
- Теллур Те
- Полоний По
Общая характеристика элементов 6 группы главной подгруппы
От O до Po (сверху вниз по периодической таблице)
Растет
- атомное радио
- металлическими, основными, восстановительными свойствами,
Уменьшается
- электроотрицательность,
- энергия ионизации,
- электронная привязанность.
Электронные конфигурации этих элементов аналогичны, все они содержат 6 электронов во внешней оболочке ns2np4:
ИЛИ – 2с2 2п4;
С, 3с23п4;
Se — 4s2 4p4;
Ре – 5с2 5п4;
По-6с2 6п4
Электронная структура кислорода и серы
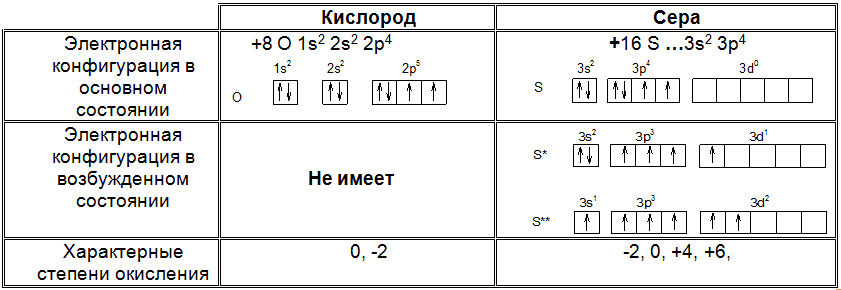
Нахождение в природе кислорода и серы
Кислород является самым распространенным элементом в земной коре. Он в основном содержится в силикатах и составляет около 47 % массы твердой земной коры. В воде содержится большое количество связанного кислорода: 85,82 % по массе. Кроме того, кислород содержится более чем в 1500 соединениях земной коры. В атмосфере доля свободного кислорода составляет 20,95 % по объему и 23,10 % по массе.
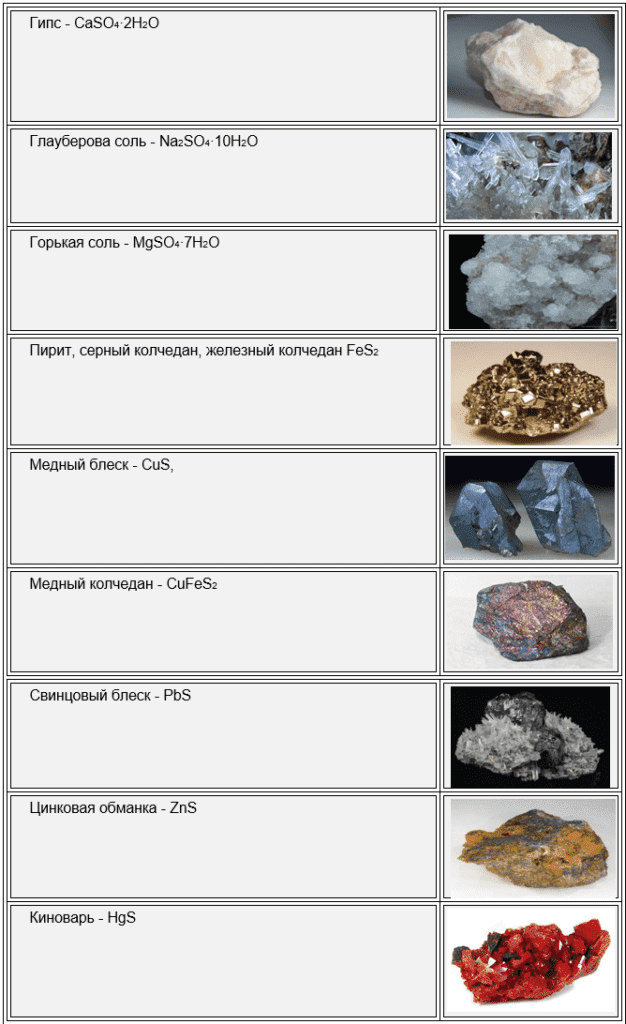
Сера встречается в виде самородной серы, сульфатов (CaSO4∙2H2O, CaSO4∙H2O, Na2SO4∙10H2O, MgSO4∙7H2O), сульфидов (FeS2, CuS, CuFeS2, PbS, ZnS, HgS) и в промышленных газах.
Самородная сера встречается в местах вулканической активности вместе с сернистыми фумаролами и сернистыми водами (с содержанием > 25 %).
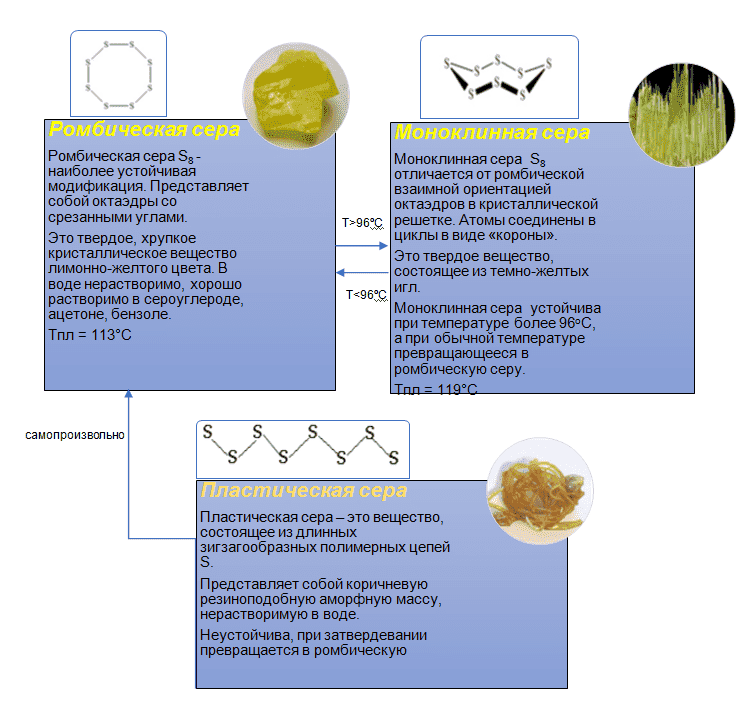
Аллотропные модификации серы
Кислород
Способы получения кислорода
В природе
Кислород образуется при фотосинтезе:
mCO2 + nH2O mO2 + См(H2O)n
Отраслевой путь
- Разделение жидкого воздуха на O2 и N2 (ректификация);
- электролиз воды:
2Н2О 2Н2 + О2
Лабораторный метод
- термическое окислительно-восстановительное разложение солей:
2KSlO3 = 3O2 + 2KCI
2KMpO4 = O2 + MnO2 + K2MpO4
2KNO3 = О2 + 2KNO2
2Cu(NO3)O2 = O2 + 4NO2 + 2CuO
2AgNO3 = О2 + 2NO2 + 2Ag
2H2O2 = 2H2O + O2 (кт - MnO2)
2HgO = 2Hg + O2
- Для автономного дыхания кислород получают в герметичных помещениях и в аппаратах по реакции:
2Na2O2 + 2СО2 = О2 + 2Na2CO3
Физические свойства кислорода
При нормальных условиях молекулярный кислород О2 представляет собой бесцветный газ без запаха и вкуса, мало растворимый в воде.
При сильном охлаждении под давлением превращается в бледно-голубую жидкость с Ткип = -183°С. В = -219 °С образует голубовато-голубые кристаллы.
Химические свойства кислорода
Кислород — сильный окислитель, по химической активности уступающий только фтору.
Вступает во взаимодействие со всеми элементами, кроме инертных газов (He, Ne и Ag). Реагирует со многими простыми веществами непосредственно при нормальных условиях или при нагревании или в присутствии катализаторов (кроме Au, Pt, Hal2, благородных газов).
Большинство реакций с участием О2 экзотермические, часто сопровождающиеся горением, иногда взрывом.
Взаимодействие с простыми веществами
С металлами
- Кислород взаимодействует с металлами с образованием оксидов металлов:
Me + O2 = оксиды MexOy
- В результате реакций с щелочными металлами образуются различные кислородсодержащие продукты:
4Li + O2 = 2Li2O оксид лития
2Na + O2 = пероксид натрия Na2O2
K + O2 = KO2 супероксид калия
- С железом образуется смесь оксидов:
3Fe + 2O2 = Fe3O4 (Fe2O3*FeO)
- С марганцем образуется диоксид марганца:
Мп + О2 = МnО2
С не металлами
При взаимодействии с неметаллами (кроме фтора и инертных газов) образуются оксиды, со степенью окисления кислорода 2:
Si + O2 = SiO2 (t=400-5000С)
С + О2(экс) = СО2; С + О2 (неделя) = СО
N2 + O2 = 2NO - Q
S + О2 = SO2;
4Р + 5О2 = 2Р2О5
Окисление сложных веществ
Горящие сульфиды
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
Горение соединений водорода
4HI + O2 = 2I2 + 2H2O
2H2S + 3O2 = 2SO2 + 2H2O
СН4 + 2О2 = СО2 + 2Н2О
Окисление оксидов
Кислород окисляет элементы, входящие в состав оксида, до более высокой степени окисления:
4FeO + О2 = 2Fe2O3
2SO2 + О2 = 2SO3
4NO2 + О2 + 2H2O = 4HNO3
Окисление гидроксидов и солей
Окисление гидроксидов и солей в водных растворах происходит, если исходное вещество неустойчиво на воздухе:
2HNO2 + О2 = 2HNO3
4Fe(ОН)2 + О2 + 2Н2О = 4Fe(ОН)3
Окисление аммиака
В отсутствие катализатора при окислении аммиака кислородом образуется азот, а в присутствии катализатора - оксид азота (II):
4NH3 + 3O2 = 2N2 + 6H2O
4NH3 + 5O2 = 4NO + 6H2O
Окисление фосфина
Самовозгорание на воздухе:
2PH3 + 4O2 = P2O5 + 3H2O
Окисление силана
На воздухе самовозгорается (часто со взрывом) с образованием SiO2 и H2O:
SiH4 + 2O2 = SiO2 + 2H2O
Окисление органических веществ
- Все органические соединения сгорают, полностью окисляясь кислородом воздуха:
CxHy + O2 = CO2 + H2O
Продукты окисления различных элементов, входящих в состав молекул органических соединений:
С СО2
Н Н2О
Хал хал2
NN2
Р P2O5
SSO2
Например:
2С2Н5 + 4О2 = 4СО2 + 5Н2О
C2H5Cl + 3O2 = 2CO2 + 2H2O + HCl
2C2H5NH2 + 8,5O2 = 4CO2 + 7H2O + N2
Помимо горения возможны также реакции парциального окисления:
- каталитическое окисление алканов с образованием спиртов или кислот:
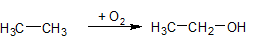
СН3-СН2-СН2-СН3 + 3О2 2СН3-СООН + 2Н2О
- каталитическое окисление алкенов с образованием этиленоксида:
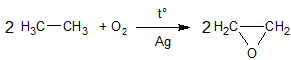
- окисление первичных спиртов в альдегиды, вторичных - в кетоны:
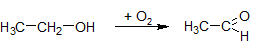
- окисление альдегидов до кислот:
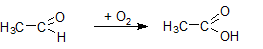
Сера
Способы получения серы
Отраслевой путь
- Добыча самородной серы из ее месторождений или вулканов
- Получение серы из сернистых руд пароводяным, фильтрационным, термическим, центробежным и экстракционным методами.
- Переработка природных газов, содержащих H2S, и их окисление при недостатке О2.
Лабораторный метод
- Взаимодействие SO2 и H2S в водном растворе:
SO2 + 2H2S = 3S + 2H2O
- Неполное окисление сероводорода:
2H2S + SO2 3S + 2H2O
Физические свойства серы
Сера представляет собой хрупкое твердое вещество желтого цвета. Не смачивается водой и практически не растворяется в ней. Имеет несколько аллотропных модификаций. См аллотропные модификации серы.
Химические свойства серы
При обычных температуре и давлении химическая активность серы мала. При нагревании сера достаточно активна и проявляет свойства как окислителя, так и восстановителя.
Сера проявляет свойства окислителя при взаимодействии с элементами, расположенными ниже и левее в таблице Менделеева, и свойства восстановителя — с элементами, расположенными выше и справа в таблице Менделеева.
Сера не взаимодействует непосредственно с азотом и йодом.
Взаимодействие с простыми веществами
С кислородом
Горение серы на воздухе с образованием оксида серы (IV):
С + О2SO2
В присутствии катализаторов:
2S + 3O2 = 2SO3
С водородом
Сера реагирует с водородом при нагревании с образованием сероводорода:
S+H2H2S
С галогенами
При взаимодействии со всеми галогенами, кроме йода, образуются галогениды:
S + Cl2 SCl2 (S2Cl2)
S+3F2SF6
С фосфором
Взаимодействие серы с фосфором приводит к образованию сульфидов фосфора
2П+3С П2С3
2П+5С П2С5
С углеродом
При реакции серы с углеродом образуется сероуглерод:
2S+CCS2
С металлами
При взаимодействии с металлами сера выступает как окислитель, образуя сульфиды.
Щелочные металлы реагируют с серой без нагревания, остальные металлы (кроме золота Au и платины Pt) - при нагревании:
S + FeFeS
S + HgHgS
3S + 2АлАл2С3
S + Cu = CuS
S + 2Ag = Ag2S
Взаимодействие со сложными веществами
С водой
Сера вступает в реакцию диспропорционирования с перегретым паром:
S + H2O (пар) 2H2S + SO2
С окислителями
В реакциях с окислителями сера окисляется до оксида серы (IV) SO2 или до серной кислоты H2SO4, когда реакция протекает в растворе:
S + 2HNO3(разн.) = H2SO4 + 2NO
S + 6HNO3(конц.) H2SO4 + 6NO2 + 2H2O
S + 2H2SO4(конц.) 3SO2 + 2H2O
S + 2KClO3 3SO2 + 2KCl
S + K2Cr2O7 = Cr2O3 + K2SO4
С + Na2SO3 Na2S2O3
Со щелочами
При взаимодействии со щелочами сера непропорциональна сульфиту и сульфиду:
S + NaOH Na2SO3 + Na2S + H2O













