Характеристика элементов главной подгруппы V группы
Элементы группы азота включают азот N, фосфор P, мышьяк As, сурьму Sb и висмут Bi. Эти элементы расположены в главной подгруппе группы V периодической системы. Как и все элементы одной подгруппы, они имеют довольно большое химическое сходство. Азот отличается от остальных. Причина такого различия будет рассмотрена ниже. Сходство химических свойств этих элементов объясняется сходством строения внешней электронной оболочки. Все они имеют 5 валентных электронов на внешней оболочке (табл. 14).
| Элемент | Депозит | Количество электронов на энергетических уровнях | Радиус атома | |||||
| К | Л | МЕТР | Север | ЛИБО | П | |||
| Азот N | +7 | два | 5 | — | — | 0,71 | ||
| Фосфор Р | +15 | два | восемь | 5 | 1.1 | |||
| Мышьяк как | +33 | два | восемь | Восемнадцать | 5 | 1,21 | ||
| Сурьма Sb | +51 | два | восемь | Восемнадцать | Восемнадцать | 5 | 1,61 | |
| Висмут Би | +83 | два | восемь | Восемнадцать | 32 | Восемнадцать | 5 | 1,15 |
По мере уменьшения радиуса атома уменьшается значение электроотрицательности, повышается металличность свойств и снижается окислительная способность.
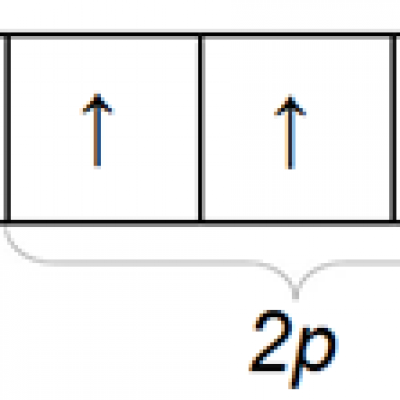
Химический знак азота N, формула N2, атомная масса 14,0067, молекулярная масса 28,0134. Электронная конфигурация атома азота 1s22s22p3. Распределение электронов по орбитам внешней оболочки:
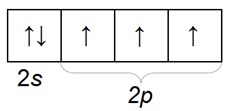
Азот имеет 3 неспаренных р-электрона на внешней электронной оболочке. При образовании неполярной молекулы азота между атомами азота образуются 3 общие электронные пары за счет перекрытия р-орбиталей обоих атомов. Таким образом, в свободном состоянии азот трехвалентен.
Степени окисления азота весьма разнообразны: от -3 до +5.
Азот немного легче воздуха. В земной коре азота 0,03%. В воздухе азот составляет 78 % по объему или 75,5 % по весу. Поскольку азот из воздуха расходуется ничтожно мало, запасы азота в атмосфере остаются постоянными.
Азот входит обязательной частью в состав белков, являющихся основой жизни на земле. Отсюда значение азота, необходимого для жизни животных и растений.
Азот — очень пассивное вещество, он с трудом вступает в реакцию, поэтому атмосферный азот очень трудно связать. Растения не усваивают атмосферный азот. Они могут усваивать его только в связанном состоянии, а урожайность урожая зависит от количества азота в почве. Азот особенно необходим растениям, у которых ценится зеленая масса. Почвенные бактерии могут фиксировать азот; некоторые из них находятся в почве в корневых клубеньках бобовых.
Для активной деятельности таких бактерий необходимо наличие молибдена и железа в виде так называемых микроэлементов. Эти элементы, а также соединения хрома, вольфрама, титана, ванадия и алюминия успешно использовались для связывания азота с органическими веществами. Поскольку азот в составе зеленой массы растений постоянно выносится с полей, почва обедняется азотом. Восполнять азотные запасы почвы необходимо минеральными удобрениями, такими как калийная селитра KNO3, натриевая селитра NaNO3 и др
Азот – бесцветный газ без запаха. В жидкое состояние переходит при температуре -195,8°, а при -210° затвердевает. Жидкий азот также бесцветен. Азот практически нерастворим в воде.
- 2. Изобразите строение атома и электронную конфигурацию электронных оболочек атома азота. Каковы сходства и различия в строении атома азота и атомов кислорода и фтора?
- 3. Представьте, как между атомами в молекуле азота возникают 3 общие электронные пары.
- 4. Какой тип кристаллической решетки имеет азот? На основании каких физических свойств азота можно об этом судить? (см ответ)
Азот химически очень инертен. При обычной температуре соединяется только с литием:
6LI + N2 = 2Li3N
С некоторыми другими металлами более активный азот может соединяться только при нагревании, образуя нитриды, в которых он всегда проявляет отрицательную степень окисления.
В очень суровых условиях азот соединяется с водородом с образованием аммиака:
N2 + 3H2 2NH3
При сильных электрических разрядах азот соединяется с кислородом, образуя окись азота:
N2 + О2 = 2НО
В свою очередь оксид азота легко окисляется кислородом воздуха и превращается в диоксид азота:
2NO + О2 = 2NO2
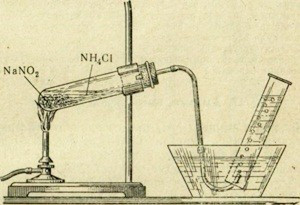
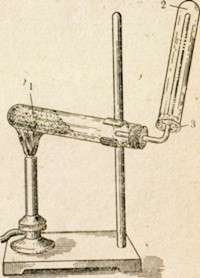
Рис. 57. Прибор для получения азота в лаборатории.
В технике азот получают из жидкого воздуха, а в лаборатории - путем разложения нитрита аммония:
NH4NO2 = N2 + 2H2O
Однако разлагать сухой нитрит аммония опасно; может произойти взрыв. Для реакции используют нитрит аммония в момент его образования из сухого хлорида аммония и насыщенного раствора нитрита натрия при нагревании (рис. 57). Сначала постепенно, путем реакции обмена, образуется нитрит аммония:
NH4Cl + NaNO2 = NaCl + NH4NO2
Далее происходит разложение нитрита аммония по приведенному выше уравнению.
Азот используется в производстве аммиака, а также в некоторых процессах для создания инертной атмосферы. Азот иногда используется для наполнения электрических ламп. Некоторые химические реагенты, которые из-за легкости окисления не могут быть получены на воздухе, получают в атмосфере азота. То же самое иногда делают при работе с легковоспламеняющимися веществами. Азот используется для синтеза аммиака.
- 5. Почему можно говорить о сравнительной химической пассивности азота? (см ответ)
в. Напишите уравнения реакций, подтверждающие химические свойства азота. - 7. Покажите расчетным путем, что азот немного легче воздуха.
- 8. Определите, какова плотность азота по водороду.
- 9. Абсолютная плотность азота 1,25 г/л. Докажите вычислением, что
молекула азота состоит из двух атомов. - 10. Запишите в тетрадь способы получения азота.
- 11. Где используется азот и на каких свойствах основано это использование? (см ответ)
Аммиак Физические свойства
Молекула аммиака NH3 представляет собой ярко выраженный диполь. Молекулярная масса аммиака равна 17. Следовательно, он намного легче воздуха. Аммиак кипит при -33,4° и затвердевает при -77,8°.
Аммиак имеет чрезвычайно высокую растворимость в воде. При 0° в 1 объёме воды растворяется 1200 объёмов аммиака, а при нормальных условиях (20°) — 700 объёмов аммиака в . 1 объем воды. Высокая растворимость аммиака обусловлена тем, что аммиак вступает в химическое соединение с водой.
Аммиак очень токсичен.
При отравлении аммиаком страдают слизистые оболочки глаз и дыхательных путей, так как аммиак растворяется в их влаге. Вдыхание большого количества аммиака может вызвать пневмонию. Лучшим противоядием от аммиака является вода. При отравлении промыть глаза, рот и нос большим количеством воды и вдохнуть водяной пар. Максимально допустимая концентрация аммиака в воздухе 0,02 мг/л.
- 12. Можно ли наблюдать растворение аммиака с помощью прибора для растворения хлористого водорода в воде (рис. 27)? (см ответ)
- 13. Каково физиологическое действие аммиака и меры первой помощи при отравлении им?
- 14. Объясните полярную природу молекулы аммиака с точки зрения ее строения. (см ответ)
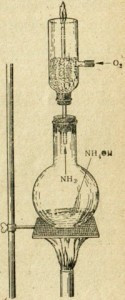
Рис. 58. Устройство для сжигания аммиака в кислород.
Химические свойства аммиака
Степень окисления азота в аммиаке N-3, то есть внешняя электронная оболочка атома азота считается максимально заполненной в сильном октете. В этом смысле аммиак может вести себя в окислительно-восстановительных реакциях только как восстановитель. Доказательством восстановительных свойств аммиака является его взаимодействие с кислородом, которое может осуществляться двумя путями.
Аммиак сгорает до кислорода.
Это легко наблюдать экспериментально в аппарате, изображенном на рис. 58. К горелке, представляющей собой широкую стеклянную трубку, присоединены две выхлопные трубы. Одна трубка подает аммиак из колбы, где кипит его насыщенный раствор, а другая трубка подает кислород из газгольдера. Если аммиак воспламеняется на выходе из трубки, он горит зеленоватым пламенем. Горение протекает по уравнению:
4NH3 + 3O2 = 2N2 + 6H2O + Q
Реакция экзотермическая.
В то же время аммиак легко окисляется в присутствии платинового катализатора:
4NH3 + 5O2 = 4NO + 6H2O
Этот процесс служит основой для производства синтетической азотной кислоты.
В обоих случаях аммиак ведет себя как восстановитель, и степень окисления азота изменяется с N-3 на N0 и N+2.
• Составить электронные весы для предыдущих уравнений и проверить правильность расстановки в них коэффициентов.
Восстановительные свойства аммиака проявляются и в возможном восстановлении им оксидов металлов:
ZCuO + 2NH3 = N2 + 3Cu + 3H2O
обогрев
- 15. Запишите в тетрадь уравнения реакций, в которых аммиак проявляет восстановительные свойства, и продемонстрируйте, составив электронный баланс. (см ответ)
Для чего аммиак
Большое значение имеют солевые соединения азота. Аммиак в основном используется в химической промышленности для получения других азотистых соединений. В качестве удобрений в сельском хозяйстве используются соли аммония, в основном аммиачная селитра, но иногда для удобрения полей используют аммиачную воду NH4OH (аммиак).
В вооруженных силах нитрат аммония используется в качестве взрывчатого вещества, а также добавляется в тринитроглицерин (динамит), чтобы уменьшить его взрывоопасность.
В химической промышленности, помимо взрывчатых веществ, аммиак используется для производства нитрокрасок, нитроэмалей, но в последнее время нитрокраски вытесняются менее токсичными материалами.
Особого внимания заслуживает вопрос о взаимодействии аммиака с водой. Как известно, молекулы воды полярны, электронная плотность сильно сдвинута в сторону кислорода, так что атом водорода практически лишен электронов и является протоном.
Молекула аммиака также полярна. 3 существующих атома водорода связываются за счет образования общих электронных пар из p-электронов атома азота и s-электронов атома водорода (sp-связь). Электроны сильно смещены в сторону атома азота как более электроотрицательного; вокруг него создается область более высокой электронной плотности. Кроме того, атом азота во внешней оболочке имеет два валентных электрона, которые можно использовать для образования химической связи.
Все это создает условия для присоединения положительно заряженного иона водорода к молекуле аммиака. А так как у иона водорода полностью отсутствуют электроны, необходимые для образования химической связи, эта связь образуется за счет двух электронов азота, которые называются «неподеленной парой электронов». Возникает атомная группа со следующей электронной структурой:
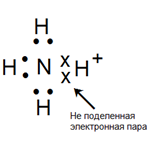
Возникает особый тип химической связи: донорно-акцепторная связь, где донором является атом, предоставляющий свою пару электронов (в данном случае азота) в общедоступном виде. Другой атом является акцептором (в данном случае атом водорода).Таким образом, возникает особая атомная группа — аммониевая группа, имеющая в целом положительный заряд за счет присоединения положительного иона водорода к нейтральной молекуле аммиака. Формула группы аммония: NH4+.
Процесс растворения аммиака в воде выражается следующим уравнением:
NH3 + H+ + OH– NH+ + OH—
Поскольку аммиак в растворе связывается с ионом водорода из воды и, таким образом, высвобождает ион ОН, это придает раствору щелочную реакцию. Вещество с формулой NH4OH называется гидроксидом аммония и считается слабым основанием. Группа аммония всегда функционирует как одновалентный катион:
NH4OH NH4+ + OH—
Концентрированный (25%) раствор аммиака называют просто нашатырным спиртом. Слабый водный раствор аммиака (3-6%) называют нашатырным спиртом. Образование аммониевой группы NH4+ возможно не только в водной среде, но и в кислоте:
NH3 + H+ + Cl— = NH4+ + Cl—
Эту реакцию можно проводить как в растворе, так и на воздухе между аммиаком и газообразным хлористым водородом.
Если смочить одну стеклянную палочку нашатырным спиртом, а другую концентрированной соляной кислотой и поднести эти палочки вплотную друг к другу (рис. 59), то можно заметить образование белого дымка, представляющего собой мельчайшие кристаллы хлорида аммония.
Гидроксид аммония вступает в реакцию нейтрализации с кислотами:
NH4OH + HNO3 = NH4NO3 + H2O
Для аммиака очень характерны реакции присоединения к различным солям, благодаря которым образуется аммиак:
CuSO4 + 4NH3 = CuSO4·4NH3
CaCl2 + 8NH3 = CaCl2 · 8NH3
AgCl + 2NH3 = AgCl · 2NH3
Они очень похожи на кристаллогидраты.

Рис. 59. Взаимодействие аммиака с хлористым водородом на воздухе.
1 брусок, смоченный концентрированным раствором нашатырного спирта; 2 - палочка, смоченная концентрированным раствором соляной кислоты; 3 - Белый дым, образованный твердыми частицами хлорида аммония.
Получение аммиака
Получение аммиака в технологии и в лаборатории осуществляется разными способами. В лаборатории аммиак получают нагреванием аммиака (хлорида аммония) и натронной извести (рис. 60) по уравнению:
2NH4Cl + Ca(OH)2 = CaCl2 + 2NH4OH
Следует отметить, что все детали устройства, используемого для производства аммиака в лаборатории, должны быть абсолютно сухими. Если бросить в воду пробирку с собранным аммиаком, то можно сразу заметить, как вода попадает в пробирку, занимая объем, занимаемый аммиаком, как это было в случае с хлористым водородом. А вот в случае с аммиаком раствор будет иметь ярко выраженную щелочную реакцию, которую можно определить по индикатору. Поскольку аммиак легче воздуха, его необходимо набирать в перевернутую пробирку.
В технологии аммиак получают синтезом из азота и водорода по уравнению:
N2 + 3H2 = 2NH3 + 22 ккал
В бывшем СССР производство синтетического аммиака началось в 1928 году.
Как было сказано выше, процесс соединения азота с водородом является равновесным каталитическим процессом. Катализатор – металлическое железо с небольшими добавками соединений калия и алюминия. Из уравнения видно, что для смещения баланса вправо целесообразно увеличить давление.
Однако повышение давления можно производить только в определенных пределах, иначе это сильно удорожает производство. Как известно, еще одним фактором, влияющим на равновесие, является температура. В этом случае для смещения равновесия вправо необходимо охлаждение газовой смеси, но тогда скорость реакции сильно снижается и активность катализатора снижается.
Поэтому температуру необходимо поддерживать на определенном уровне. Можно использовать и влияние третьего фактора — изменения концентрации: если образующийся аммиак постоянно удалять, т е уменьшать его концентрацию, то равновесие будет смещаться вправо. Как видно из приведенного выше описания, достаточно полный и рентабельный синтез может быть осуществлен при наилучшем сочетании трех условий.
Процесс обычно проводят в колоннах синтеза при давлении 300—1000 атм и температуре 400—500°. В процессе синтеза из смеси постоянно удаляют аммиак, переводя ее в жидкое состояние, а непрореагировавшую азотно-водородную смесь направляют обратно в колонну синтеза.













